1. はじめに
サイクリックボルタンメトリー(CV)は、重要かつ広く利用されている電気化学分析手法です。CVは、充放電サイクル中における材料のさまざまな電気化学特性、例えば相転移、電極反応速度、律速段階、反応動力学などを解析する上で、代替不可能な役割を果たします。特定の電圧を印加し、電流と電圧の変化を測定することで、材料の電気化学挙動曲線を得ることができます。これにより、電極反応の基本的なプロセスやその進行に影響を与える主要因が明確となり、電極反応の方向や速度を意図的かつ効果的に制御することが可能になります。その結果、生産および科学研究の双方において、信頼性の高い理論的指針を提供します。
複数掃引速度CVとは、異なる掃引速度で取得されたCV測定を指します。異なる掃引速度におけるCV曲線の意義は、曲線形状から電極反応の可逆性を評価できる点にあり、さらに中間体の存在、相境界吸着、新しい相の形成、または化学反応の連動性などの可能性を判断することができます。このため、電池材料や触媒などの分野で広く応用されています。
2. 複数掃引速度CV試験の原理と方法
サイクリックボルタンメトリー(CV)は、逆方向の二重電位ステップクロノアンペロメトリーの一種です。一定時間間隔の後、電位は反転し、正電位方向に向かって掃引されます。電位が連続的に上昇すると、酸化反応の傾向が強まり、酸化電流が発生します。可逆性の高い反応では、逆方向の電流は正方向の電流と類似した形状を示します。
CVは、電極表面に線形に変化する電位(電圧)を印加し、それに対応する電流応答を観測することで、電気化学反応の速度論や機構を調査します。この手法では、電極電位を制御し、電位の変化中に電極を流れる電流を記録することにより、電流‐電位(i-E)プロットを得ます。
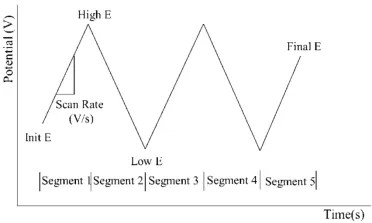
方法の原理:
この手法では、電極に線形に変化する電圧(一定傾斜の電圧ランプ)を印加します。掃引範囲は通常、静止電位から±3 Vの範囲に限定され、この範囲内でほとんどの電極反応が起こります。一般的には±5 Vを超えることはありません。
掃引方程式:
サイクリックボルタンメトリーにおいて、初期掃引電位は次の式で表されます:
E = Ei - vt (1)
ここで:
Ei = 初期電位
t = 時間
v = 電位変化速度(掃引速度)
逆方向掃引は次式で定義されます:
E = Ei + v′t (2)
ここで v′ は多くの場合 v に等しいです。
電流応答のメカニズム:
これらの式をネルンスト方程式の適切な形と組み合わせることで、電極表面における粒子フラックスを記述する式が導かれます。この式は逐次数値積分によって解くことが可能です。
印加電圧が電極プロセスの可逆電位に近づくと、小さな初期電流が観測されます。この電流は反応速度論の加速により急速に増加します。しかし、電極表面付近の反応物が枯渇するにつれ、標準電位をわずかに超える電位で電流は有限の限界値に達します。この移行は拡散律速挙動の開始を示し、反応物の枯渇によってバルク溶液にまで及ぶ濃度勾配が形成されます。拡散層が徐々に厚くなるにつれ、電極界面における拡散による物質移動速度はそれに応じて低下します。その結果、電流は最大値(ピーク電流)に達した後、電圧の変化が続いても特徴的な減少を示し、電気化学反応速度よりも拡散律速による物質移動が支配的となることが明らかになります。
可逆的な還元のピーク電流は次のように定義されます:
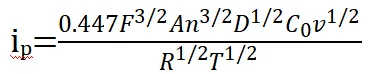 (3)
(3)
ip = ピーク電流
n = 電子移動数
F = ファラデー定数(96,485 C/mol)
D = 反応物の拡散係数
C0 = 酸化状態の反応物濃度
A = 電極面積
CVの解析能力:CVは、電極プロセスに関する定性的および定量的情報の両方を提供します。拡散律速の可逆反応においては、次のように表されます:
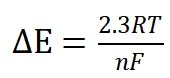 (4)
(4)
主要な特性:
可逆系:
このピーク電位差(ΔEp)は掃引速度に依存しません。
非拡散律速反応(例:不溶性膜の酸化):
電析された不溶性膜の可逆酸化において、もし反応が拡散律速でない場合、観測されるΔE値は式(4)で予測される値よりも著しく小さくなります。
準可逆プロセス:
· 電流ピークがより広く分離する
· 最大値付近のピーク形状が広がり(より丸みを帯び)
· ピーク電位が掃引速度に依存する
· ΔE値が式(4)で与えられる値を超える
速度論的解析方法:
中央値ピーク電位(Em)と掃引速度(v)の関数関係を回帰分析することで、ΔEおよびk(電子移動速度定数)の両方を求めることができます。
ただし、解析には式(5)を用いる方がはるかに便利です。
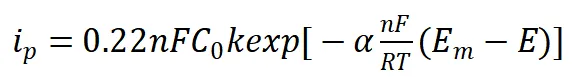 (5)
(5)
複数掃引速度のサイクリックボルタンメトリー(CV)では、掃引速度の増加に伴い特有の曲線変化が現れます。低掃引速度では、電極表面における酸化還元反応がより完全に進行し、CV曲線上に高い電流ピークとして現れます。しかし、この反応の完全性が高まる一方で、物質移動の制限も同時に強まります。これに対して、高掃引速度では物質移動抵抗が減少しますが、反応が不完全となり、電流ピークは小さくなります。根本的には、このピーク電流現象は、外部で制御される要因(印加電位)が一方向の変化を駆動する一方で、拡散などの系内在的な力が逆方向に作用する競合に起因します。この動的競合が、正逆両方向の過程が一時的平衡に達した時点でピークを形成するのです。
基本となる電流式 j = nFAkc は、電極面積(A)が固定されている場合、ピーク挙動が次の2つの変数に依存することを示しています:
· 活性化エネルギーによって決まる反応速度定数(k、電位依存性)
· 電極表面の反応物濃度(c、物質移動によって制御)
速度論的に速い系におけるピーク生成は以下の順序で進行します。初期の電位掃引中、反応消費速度が拡散供給速度を上回り、表面濃度が減少して濃度勾配が形成されます。電位の進行に伴い、表面濃度の減少はこの勾配を急峻化させ、電極表面で反応物が枯渇(c→0)した時点で最大濃度勾配が生じ、これがピーク電流(ip)に対応します。その後の電位変化により、拡散層が厚くなり、濃度勾配が緩和し、電流は減少して拡散律速状態へ移行します。
3. 複数掃引速度CV試験:設定パラメータと得られる情報
3.1 主なパラメータ、設定可能範囲および典型設定
初期電位(掃引開始点、通常は開回路電圧に設定)は -10 V ~ +10 V の範囲で設定可能です。水系では一般的に ±2.0 V の範囲に収まり、有機系では ±5.0 V まで拡張されます。電池系ではより広い範囲が必要となる場合があります。終端電位も同様の設定原則に従います。電位リミットに関しては、上限頂点電位が最大掃引境界を定義し、下限頂点電位が最小閾値を定め、いずれも実験要件に応じて ±10 V の範囲で調整可能です。
クワイエットタイム(掃引前の安定化時間)は 1~100,000 秒の範囲で設定でき、典型的な実験では 5~60 秒が用いられます。掃引速度(電位変化速度)は 1×10⁻⁴ ~ 10,000 V/s の範囲をカバーします。定常状態測定では通常 mV/s の範囲(1~50 mV/s)が使われ、標準的な電極研究では 0.01~5 V/s が用いられます。超高速動力学を調べる微小電極研究では kV/s 領域に達することもあります。なお、高掃引速度では大きな電流が生じるため、溶液抵抗補償が必要です。サイクル数は 1~500,000 回まで調整可能で、ほとんどの実験では 3~50 サイクルが一般的です。1 サイクルあたりのデータポイントはデフォルトで 2000 点であり、総データポイントは 2000 × サイクル数となります。
3.2 得られる情報
複数掃引速度のサイクリックボルタンメトリーは、包括的な電気化学的知見を提供します:
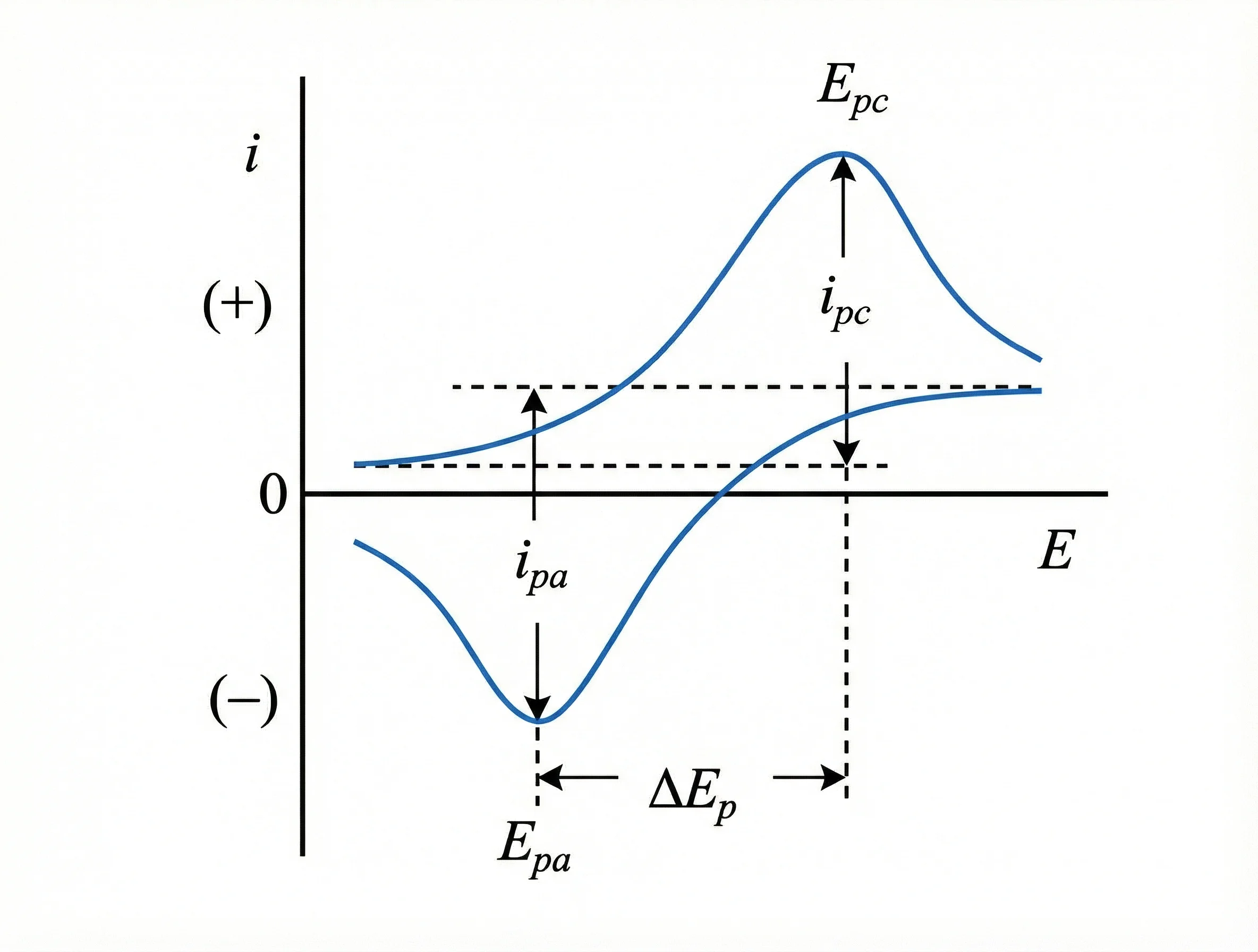
(1) 可逆性の評価は、還元ピーク(Epc)と酸化ピーク(Epa)の対称性によって判断されます。ピーク電位差が ΔEp ≤ 59/n mV(n = 298 K における電子移動数)を満たす場合、反応は可逆的と見なされます。
(2) 正式酸化還元電位(E1/2)は、酸化ピーク電位と還元ピーク電位の平均値として算出されます。
(3) 電子移動数(n)は、ΔEp およびピーク電流比(ip,a/ip,c)から推定できます。
(4) 可逆/準可逆系の電気化学反応速度定数(k⁰)は、CV 曲線形状の解析および掃引速度依存のピーク電流挙動から導かれます。
(5) 拡散係数(D)は、Randles-Sevcik 方程式を用いて定量化されます。
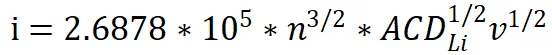
ここで、ip = ピーク電流(A)、A = 電極面積(cm²)、C = バルク濃度(mol/cm³)、v = 掃引速度(V/s)です。
(6) 吸着/脱離プロセスに関与する表面活性サイトは、CVピーク特性によって評価されます。
(7) 二重層容量は非ファラデー領域において評価可能であり、電極界面特性を明らかにします。
(8) CV曲線の形態、ip-v1/2 関係、電解質濃度依存性の解析によって反応機構が推定されます。
4. 応用シナリオ
複数掃引速度のサイクリックボルタンメトリー(CV)は、電池内の電気化学的酸化還元プロセスに関する重要な知見を提供し、エネルギー貯蔵メカニズムや電気化学性能の研究に不可欠な手法です。電池技術における主要な応用分野は以下のとおりです。
(1) 電極可逆性の評価
双方向の電圧掃引(カソード/アノード)により、酸化/還元ピーク電位(Epa/Epc)やCV曲線のピーク電流対称性を通じて反応の可逆性を評価します。
(2) 定量分析
酸化ピーク電流と被測定物濃度の線形関係に基づき、微量中間体を定量的に測定することができます(検出限界:μM~nMレベル)。
(3) 電極開発
電極触媒の合成:エタノール酸化研究のためのPt-Sn/GCE電極のCVを利用した製作
先進コーティング:スーパーキャパシタ応用向けグラファイト基板上へのPbO₂膜の電析
(4) 性能ベンチマーク
以下の主要指標を評価します:
· サイクル安定性
· 電圧プラトー特性
· 静電容量寄与と拡散律速寄与の分離
(5) 反応機構の解明
以下の要素を分析します:
· ピークの多重化や広がり
· ピークシフトの動態
· イオン拡散速度論(例:Li⁺の挿入/脱離)
(6) 不具合診断
CV比較分析により以下を評価します:
· サイクル数 → 容量劣化メカニズム
· 掃引速度 → 構造劣化パターン
(7) 教育・トレーニング
以下の教育において不可欠なツールです:
· 電池動作原理
· 電気化学分析手法
(8) 標準化
業界標準の性能試験プロトコル開発を支援します。
(9) 安全性試験
ピーク分離(ΔEp)は分極の程度と相関します:
· ΔEp が大きい → 過充電/熱暴走リスクが高い
· これは耐久性・耐乱用性の検証において極めて重要です。
(10) LSVCVとの相関
CVピークは dQ/dV 特徴と対応しますが、リニアスイープボルタンメトリー(LSV)に比べ、より優れた速度論的情報を提供します。
5. 結論
複数掃引速度CV試験は、電池研究開発において不可欠なツールです。本手法は、複雑な内部電気化学反応を明らかにするだけでなく、研究者に電池材料や構造の最適化を可能にし、全体的な性能向上を実現します。特に、以下の分野において重要な知見を提供します。
· 性能ベンチマーク
· 反応機構の解明
· 故障モードの診断
電池技術が進展する中で、複数掃引速度CVは性能最適化および新規電池開発の基盤として今後も重要な役割を担い続けるでしょう。